1 - Eksponert akvakultur
1.1 - Fremtiden er akvakultur
I løpet av den siste halvdel av det tjuende århundre har den globale akvakultur-produksjonen steget dramatisk fra mindre enn 1 million tonn i 1950 til 16 millioner tonn i 1990 og 78 millioner tonn i 2010 (FAO, 2011) og er fortsatt stigende. I sterk kontrast til dette har den globale fangst i kommersielt fiskeri stagnert siden slutten av 80-tallet. Konsekvensen av disse motgående veksttendenser har betydd at over halvparten av fisk og skalldyr spist av mennesker siden 2014 kommer fra akvakultur (FAO, 2016). Det er imidlertid verdt å bemerke at en betydelige større biomasse kommer fra fiskeri, ettersom de fleste marine fiskeproduserende akvakultur-industrier i dag er delvis avhengige av fôr laget av villfisk.
Tidsmessig er det meget interessant, at akvakultur nå er begynt å vise potensial til å overgå fiskeri som den viktigste næringskilden fra havet. Ikke minst tatt i betraktning av at fiskeri inntil nå har dominert over akvakultur i århundrer, mens situasjonen på landjorden har vært omvendt, hvor landbruk ble viktigere enn jakt på et mye tidligere tidspunkt i menneskets historie. Med tanke på at kommersielt fiskeri også utnytter en del ville populasjoner over grensen for hva som er bærekraftig, mens befolkningsveksten i verden øker mer enn noensinne, er det innlysende at akvakultur vil bli enda viktigere i fremtiden. Det er derfor helt sentralt, at den stadige utvikling og vekst av ulike akvakultur-operasjoner blir mer bærekraftig. For eksempel vil det på sikt ikke være bærekraftig å være avhengig av fôr laget av villfisk hvis akvakultur-produksjonen skal økes betydelig. Et viktig forskningsområde er derfor utvikling og implementering av alternative fôrkilder, som eksempelvis kan være basert på planter eller insekter (Henry et al., 2015; Hamre et al., 2016). Denne utvikling er på gang, og allerede kommer omtrent 80% av fôret til laks fra landjorda.
1.2 - Atlantisk laks
En av verdens viktigste oppdrettsarter er Atlantisk laks Salmo salar (L. 1758) (Tabell 1) (FAO, 2018). Laksens store popularitet skyldes at den er forholdsvis lett å håndtere, reprodusere, den vokser raskt, har en høy kommersiell markedsverdi, er ytterst fleksibel til å tilpasse seg forskjellige og ofte varierende oppdrettsmiljøer (Heen et al., 1993).
Atlantisk laks blir oppdrettet, delvis beskyttet fra havet, langs kystene i Europa, Nord Amerika, Chile og Tasmania. Den globale produksjon har steget jevnt fra omtrent 0.2 millioner tonn i 1990 til mer enn 2 millioner tonn i 2012 og stabilisert seg deretter (FAO, 2019). Norge er verdens største produsent av Atlantisk laks, og det er et politisk ønske å tilrettelegge for videre bærekraftig vekst. (Aarre, 2017).
Den største nåværende hindring for vekst i norsk lakseoppdrett er lakselus, Lepeophtheirus salmonis (Krøyer 1837). Lakselusen er en ektoparasitt, som setter seg fast på laksen, hvor den spiser av slim, skinn og blod (Costello, 2006). Estimerte kostnader for behandling mot lakselus var i 2011 på 3706 millioner kroner, men i dag er kostnadene sannsynligvis betydelig høyere (Abolofia et al., 2017). Foruten de store kostnadene med kontroll av lakselus, fungerer sjømerder også som reservoar for parasitten, hvorfra dens larver fritt blir spredt med kyst- og havstrømmene til det omkringliggende miljø. Lakselusens kopepoditt (larver) har mulighet til å infestere alle laksefisker, inkludert villaks, og kan utgjøre en betydelig risiko for migrerende ungfisk på vei til havs (Costello, 2006).
En annen viktig miljøutfordring er at rømt oppdrettsfisk formerer seg med lokale villfisk populasjoner. Oppdrettslaks er blitt et husdyr, som gjennom generasjoner er kunstig selektert til å prestere optimalt i oppdrettsmiljøet, og vil derfor ha et dårligere genetisk utgangspunkt til å klare seg i naturen. Det betyr, at når genpoolen mellom vill- og oppdrettsfisk blandes, risikerer vi å få en laks som er dårligere tilpasset til de mange utfordringer i dens naturlige miljø (Glover et al., 2017).
Andre utfordringer er blant annet at lakseoppdrett slipper ut betydelige mengder næringsstoffer til miljøet, som kan forårsake eutrofiering og endringer av balansen i de lokale økosystemer (Wang et al., 2012; Verdegen, 2013). Dessuten finnes det mange andre parasitter og sykdommer utover lakselus, som jevnlig utgjør problemer ved intensiv lakseproduksjon. Her kan blant annet nevnes pankreas sykdom fra salmonid alphavirus (SAV) og amøbisk gjellesykdom (AGD), som skyldes amøben Paramoeba perurans (e.g. Taksdal et al., 2007; Oldham et al., 2016). På samme måte som med lakselus, kan andre sykdommer og parasitter på tilsvarende vis spres mellom oppdrettslokaliteter og også til villfisk. Eksempelvis er AGD inntil videre blitt påvist hos 17 forskjellige arter (Oldham et al., 2016; Kim et al., 2017), hvor de potensielle konsekvenser for ville fisk kan være meget vanskelige å dokumentere og forutsi (Hvas et al., 2017a).
For å imøtekomme industriens store ambisjoner om økt vekst i norsk lakseoppdrett, er det en absolutt nødvendighet å utvikle nye teknologier og strategier som kan redusere parasitt-infestasjoner og minimere annen negativ miljøpåvirkning.
1.3 - Etablering av nye lokaliteter til havs kan imøtekomme ønsket om bærekraftig vekst
Oppdrettslokaliteter i Norge har tradisjonelt lagt inne i fjordene eller langs kysten, beskyttet mot de mest ekstreme værforhold. I dag er det vanskelig å få tillatelse til nyetablering på tradisjonelle områder, så lenge de negative effekter på miljøet ikke er løst eller håndtert på en bedre måte.
En ny viktig strategi for lakseindustrien er derfor at flytte produksjonen vekk fra disse tradisjonelle og beskyttede områder til lokaliteter lengre vekk fra kysten, der forholdene er mer eksponert og isolert (Bjelland et al., 2015; Gentry et al., 2017). Hva som kjennetegner en eksponert lokalitet har på nåværende tidspunkt ikke en klar definisjon, men kan forstås som ett oppdrettsanlegg plassert på en mer øde beliggenhet vekk fra kysten eller til havs, hvor utfordrende værforhold som eksempelvis sterke vannstrømmer og kraftige bølger forventes fra tid til annen.
Der er en rekke mulige fordeler ved å flytte lakseoppdrett til mer eksponerte områder. For eksempel forventes det at vannkvaliteten er bedre for fisken på grunn av mer effektiv vangjennomstrømming. Mer stabile vertikale gradienter i temperatur, oksygen og saltholdighet vil kunne øke produksjonskapasiteten. Problemer med utslipp av næringsstoffer til miljøet forventes også å bli betydelig mindre, da disse vil blir omsatt og fortynnet ut på et langt større volum. Ettersom eksponerte lokaliteter vil være mer isolert, unngår man også interessekonflikter med andre aktiviteter som finnes inne i fjordene (Holmer, 2010; Bjelland et al., 2015). Dessuten vil risikoen for overføring av patogener mellom oppdrettsanlegg sannsynligvis også bli mindre på grunn av de økte avstander.
En rekke utfordringer er derimot også forbundet med å flytte lakseoppdrett ut på mer eksponerte områder. Dette innebærer blant annet behov for nye teknologier, infrastrukturer og operasjonelle rutiner på grunn av den økte risiko for ekstreme værforhold samt at anleggene blir generelt mindre tilgjengelige (Loverich & Gace, 1997; Fredheim & Langan, 2009; Bjelland, 2016). Eksempelvis må anleggsstrukturene dimensjoneres og designes for større krefter, og slik at notdeformasjoner unngås i perioder med sterk vannstrøm (Lader et al., 2008; Klebert et al., 2015; Gansel et al., 2018).
For å imøtekomme disse utfordringer har det derfor de siste årene blitt gjort omfattende forskning og investeringer hos lakseindustrien til utvikling av nye teknologier og konsepter rettet mot eksponert oppdrett. Den bakenforliggende motivasjonen er åpenbar, ettersom potensialet for vekst i lakseproduksjon nærmest er ubegrenset dersom store nye sjø - og havområder kan utnyttes til akvakultur.
1.4 - Dyrevelferd: Hvordan vil laksen klare seg i eksponerte omgivelser?
Det viktigste spørsmål som oppstår når mulighetene for lakseoppdrett på mer eksponerte lokaliteter skal vurderes, er imidlertid, om fisken faktisk vil trives i de mer ekstreme miljøer. Vi må ta hensyn til laksens grunnleggende biologiske behov, og dagens fremskritt i teknologiutvikling blir da nytteløse hvis ikke det er mulig å produsere fisk på en effektiv og ansvarlig måte. Med andre ord, vi må sikre at fiskens velferd er ivaretatt før fundamentalt nye oppdrettskonsepter og miljøer tas i bruk.
Fisk har en velutviklet kognitiv kapasitet, som demonstrert i adskillige vitenskapelige studier. For eksempel kan fisk huske og lære, noe som gjør dem i stand til at forutse begivenheter og ha en fornemmelse av tid, fisk kan skille mellom gruppeindivider og samarbeide, og det finnes til og med eksempler på fisk som har lært å bruke redskaper (Branson, 2008; Nilsson et al., 2010; Millot et al., 2014; Noble et al., 2018). Derfor har fisk ifølge norsk lovverk status som bevisste organismer, som forøvrig også omfatter alle vertebrater (pattedyr, fugler, dinosaurer, krypdyr og padder), og er beskyttet av Dyrevelferdsloven (Dyrevelferdsloven, 2009).
Dyrevelferdsloven tar utgangspunkt i de fem friheter, som opprinner fra Brambell komiteens arbeid i 1965. Disse er frihet fra sult og tørst, frihet fra ubehag, frihet fra smerte, skader og sykdom, frihet til å utrykke normal adferd, og frihet fra frykt og nød. Det er i praksis dog umulig å leve opp til alle disse standarder til enhver tid. De fem friheter skal derfor fortolkes som retningslinjer til og evaluere etiske aspekter under kommersiell dyreproduksjon, og kan brukes til å identifisere måter for hvor dyrevelferden kan forbedres. Å sikre god dyrevelferd har ikke kun etisk egenverdi, forbrukerne etterspør i stigende grad produkter som er produsert med omtanke. Fra produsentenes side er det også en stor fordel å ivareta god fiskevelferd, da fisk som er oppdrettet i et gunstig fysisk og sosialt miljø vil ha bedre appetitt og vekst samt ha større sannsynlighet for å overleve en hel produksjonssyklus sammenlignet med fisk som er stresset, syk eller såret.
Fiskevelferd i akvakultur blir i praksis vurdert gjennom en rekke velferdsindikatorer, som enten er direkte eller indirekte. Direkte indikatorer er basert på observasjoner og målinger av selve fisken som for eksempel kondisjonsfaktor, skader, parasitter og atferd. Indirekte indikatorer er basert på målinger i fiskens miljø, og kan for eksempel være oksygen nivå, vanntemperatur og fisketetthet (Noble et al., 2018).
Når nye oppdrettskonsepter, nye behandlingsmetoder eller andre nye teknologiske tiltak tas i bruk, er det viktig å undersøke risikoen for eventuell dårlig velferd. Dette er særlig relevant for eksponert akvakultur, ettersom der her er snakk om helt nye kombinasjoner av teknologier og miljøbetingelser når fisken blir utsatt for mer ekstreme forhold. Mange standardiserte rutineoperasjoner fra tradisjonelle beskyttede lokaliteter som eksempelvis fôring, transport og lusebehandlinger vil mer komplisert på eksponerte lokaliteter og dermed gi nye utfordringer for å opprettholde god velferd.
De mest spesifikke bekymringene i forhold til velferd i eksponert akvakultur er hvordan sterk vannstrøm og kraftfulle bølger vil påvirke laksen.
Tabell 1.1. Liste over de viktigste fiskearter i akvakultur. Legg merke til at de arter som har en høyere årlig produksjon enn Atlantisk laks alle er ferskvannsfisk. Mulighetene for å øke produksjonen ytterligere ved etablere nye oppdrettsfasiliteter til havs er derfor ikke mulig for disse artene. Modifisert fra FAO (2018).
| Art |
Global produksjon i 2016 (tusen tonn) |
| Gresskarpe, Ctenopharyngodon idellus |
6068 |
| Sølvkarpe, Hypophthalmichthys molitrix |
5301 |
| Alminnelig karpe, Cyprinus carpio |
4557 |
| Niltilapia, Oreochromis niloticus |
4200 |
| Marmorkarpe, Hypophthalmichthys nobilis |
3527 |
| Carassius spp. |
3006 |
| Catla, Catla catla |
2961 |
| Atlantisk laks, Salmo salar |
2248 |
| Pangasius, Pangasius spp. |
1741 |
| Regnbueørret, Oncorhynchus mykiss |
814 |
9 - Referanser
Aarre, E. (2017). Miljøproblemer hindrer vekst i oppdrettsnæringen. Aftenposten 7. mai. 2017.
Abolofia, J., Asche, F. & Wilen, J. (2017). The cost of lice: quantifying the impacts of parasitic sea lice on farmed salmon. Marine Resource Economics 32(3), 329-349.
Alsop, D.H. & Wood, C.M. (1997). The Interactive effects of feeding and exercise on oxygen consumption, swimming performance and protein usage in juvenile rainbow trout (Oncorhychus mykiss). Journal of Experimental Biology 200, 2337–2346.
Anttila, K., Couturier, C. S., Øverli, Ø., Johnsen, A., Marthinsen, G., Nilsson, G. E. & Farrell, A. P. (2014). Atlantic salmon show capability for cardiac acclimation to warm temperatures. Nature Communications 5, 4252.
Barratt, B., Berndt, L., Dodd, S., Ferguson, C., Hill, R., Kean, J., Teulon, D. & Withers, T. (2007). Selecting biological control agents. [online] BIREA. Available at: http://www.b3nz.org/birea/
Beamish, F. W. H. (1978). Swimming capacity. In: Hoar WS, Randall DJ (eds) Fish physiology. Academic Press, New York, NY, p 101−187.
Bjelland, H., Føre,M., Lader, P., Kristiansen, D., Holmen, I.M., Fredheim, A., Grøtli, E.I., Fathi, D.E., Oppedal, F., Utne, I.B. & Schjølberg, I., (2016). Exposed aquaculture in Norway Technologies for robust operations in rough conditions. Proceedings from OCEANS' 15 MTS/IEEE, Washington, USA, 19–22 October 2015, pp. 1–10.
Black, E. C. (1958). Hyperactivity as a lethal factor in fish. J. Fish. Res. Bd Can. 15, 245-251.
Blanco Gonzalez, E. & de Boer, F. (2017). The development of the Norwegian wrasse fishery and the use of wrasses as cleaner fish in the salmon aquaculture industry. Fisheries Science 83(5), 661-670.
Brambell, R. (1965). Report of the Technical Committee to Enquire Into the Welfare of Animals Kept Under Intensive Livestock Husbandry Systems. Cambridge. 92 pp.
Branson, E. (2008). Fish Welfare. Oxford: Blackwell Publishing.
Brett, J. R. (1964). The respiratory metabolism and swimming performance of young sockeye salmon. J Fish Res Board Can 21, 1183−1226.
Bui, S., Dempster, T., Remen, M., Oppedal, F. (2016). Effect of ectoparasite infestation density and life-history stages on the swimming performance of Atlantic salmon Salmo salar. Aquacult Environ Interact 8, 387-395.
Burgetz, I. J., Rojas-Vargas, A., Hinch, S.G. & Randall, D. J. (1998). Initial recruitment of anaerobic metabolism during submaximal swimming in rainbow trout (Oncorhynchus mykiss). Journal of Experimental Biology 201, 2711−2721.
Byrne, M., Currin, S. & Hill, M. (2002). The influence of climate on the establishment and success of the biocontrol agent Gratiana spadicea, released on Solanum sisymbriifolium in South Avrica. Biological Control, 24(2), pp.128-134.
Cartwright, D. (1995). Optimization of biological control of Rhizoctonia stem rot of poinsettia by Paecilomyces lilacinus and Pseudomonas cepacia. Plant Disease 79(3), 301-308.
Costello, M. (2006). Ecology of sea lice parasitic on farmed and wild fish. Trends in Parasitology 22(10), 475-483.
Crawley, M. (1986). The population biology of invaders. Philosophical Transactions of the Royal Society of London, 314(1167), pp.711-731.
Dam, P, S. (2015). A study on Atlantic salmon (Salmo salar) in aquaculture: Moving into exposed waters, the effect of waves on behaviour and growth. Master thesis. University of Copenhagen. Denmark.
Drenner, S.M., Clark, T.D., Whitney, C.K., Martins, E.G., Cooke, S.J., et al. (2012). A synthesis of tagging studies examining the behaviour and survival of anadromous salmonids in marine environments. PLoS One 7 (3), e31311.
Dyrevelferdsloven (2009). Lov om dyrevelferd. LOV-2009-09-19-97.
Evans, D. H., Piermarini, P. M. & Choe, K. P. (2005). The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste. Physiol Rev 85, 97–177.
FAO. (2011). Global Aquaculture Production. Fishery Statistical Collections. Rome.
FAO. 2016. The State of World Fisheries and Aquaculture 2016. Contributing to food security and nutrition for all. Rome. 200 pp.
FAO. 2018. The State of World Fisheries and Aquaculture 2018 - Meeting the sustainable development goals. Rome. Licence: CC BY-NC-SA 3.0 IGO.
FAO. (2019). Species Fact Sheets: Salmo salar (Linnaeus, 1758). Rome.
Farrell, A. P., Thorarensen, H., Axelsson, M., Crockerd, C. E., Gamperl, A. K. & Cech, J. J. (2001). Gut blood flow in fish during exercise and severe hypercapnia. Comp. Biochem. Physiol. A 128, 549–561.
Farrell, A. P. (2002). Cardiorespiratory performance in salmonids during exercise at high temperature: insights into cardiovascular design limitations in fishes. Comp. Biochem. Physiol. A 132, 797-810.
Frank, K., Gansel, L.C., Lien, A.M., Birkevold, J., 2013. Effects of a shielding skirt for prevention of sea lice on the flow past stocked salmon fish cages. J. Offshore Mech. Arct. Eng. 137 OMAE-13-1062; doi: 10.1115/1.402826
Fredheim, A. & Langan, R. (2009). Advances in technology for off-shore and open ocean finfish aquaculture. In: Burnell, G., Allan, G. (Eds.), New Technologies in Aquaculture: Improving Production Efficiency, Quality and Environmental Management. Woodhead Publishing in Food Science, Technology and Nutrition, pp. 914–944.
Fry, F. E. J. (1971). The effect of environmental factors on the physiology of fish. In Hoar, W. S., Randall, D. J. (eds). Fish Physiology, 6. Academic Press, New York. 1–98.
Gansel, L. C., Oppedal, F., Birkevold, J. & Tuene, S. (2018). Drag forces and deformation of aquaculture cages—Full-scale towing tests in the field. Aquaculture Engineering 81, 46-56.
Gentry, R. R., Froehlich, H. E., Grimm, D., Kareiva, P., Parke, M., Rus,t M., et al. (2017). Mapping the global potential for marine aquaculture. Nat. Ecol. Evol. 1, 1317-1324.
Glover, K. A., Solberg, M. F., McGinnity, P., Hindar, K., Verspoor, E., Coulson, M. W., Hansen, M. M., Hitoshi, A., Skaala, Ø. & Svåsand, T. (2017). Half a century of genetic interaction between farmed and wild Atlantic salmon: Status of knowledge and unanswered questions. Fish and Fisheries 18, 890–927.
Grefsrud, E.S., Glover, K., Grøsvik, B.E., Husa, V., Karlsen, Ø., Kristiansen, T., Kvamme, B.O., Mortensen, S., Samuelsen, O.B., Stien, L.H., Svåsand, T., (red.), 2018. Risikorapport for norsk fiskeoppdrett. Fisken og Havet, særnummer 1-2018, 184s.
Grimnes, A., Jakobsen, P.J. (1996). The physiological effects of salmon lice (Lepeophtheirus salmonis) infection on post smolts of Atlantic salmon (Salmo salar). J Fish Biol 48: 1179−1194.
Hamre, K., Sissener, N. H., Lock, E., Olsvik, P. A., Espe, M., Torstensen, B. E., Silva, J., Johansen, J., Waagbø, R. & Hemre, G. (2016). Antioxidant nutrition in Atlantic salmon (Salmo salar) parr and post-smolt, fed diets with high inclusion of plant ingredients and graded levels of micronutrients and selected amino acids. PeerJ 4:e2688.
Heen, K., Monahan, R. L., Utter, F. (1993). Salmon Aquaculture. Halstead Press.
Henry, M. A., Gasco, L., Piccolo, G. & Fountoulaki, E. (2015). Review on the use of insects in the diet of farmed fish: Past and future. Animal Feed Science and Technology 203, 1-22.
Holmer, M. (2010). Environmental issues of fish farming in offshore waters: perspectives, concerns and research needs. Aquaculture Environment Interactions 1, 57–70.
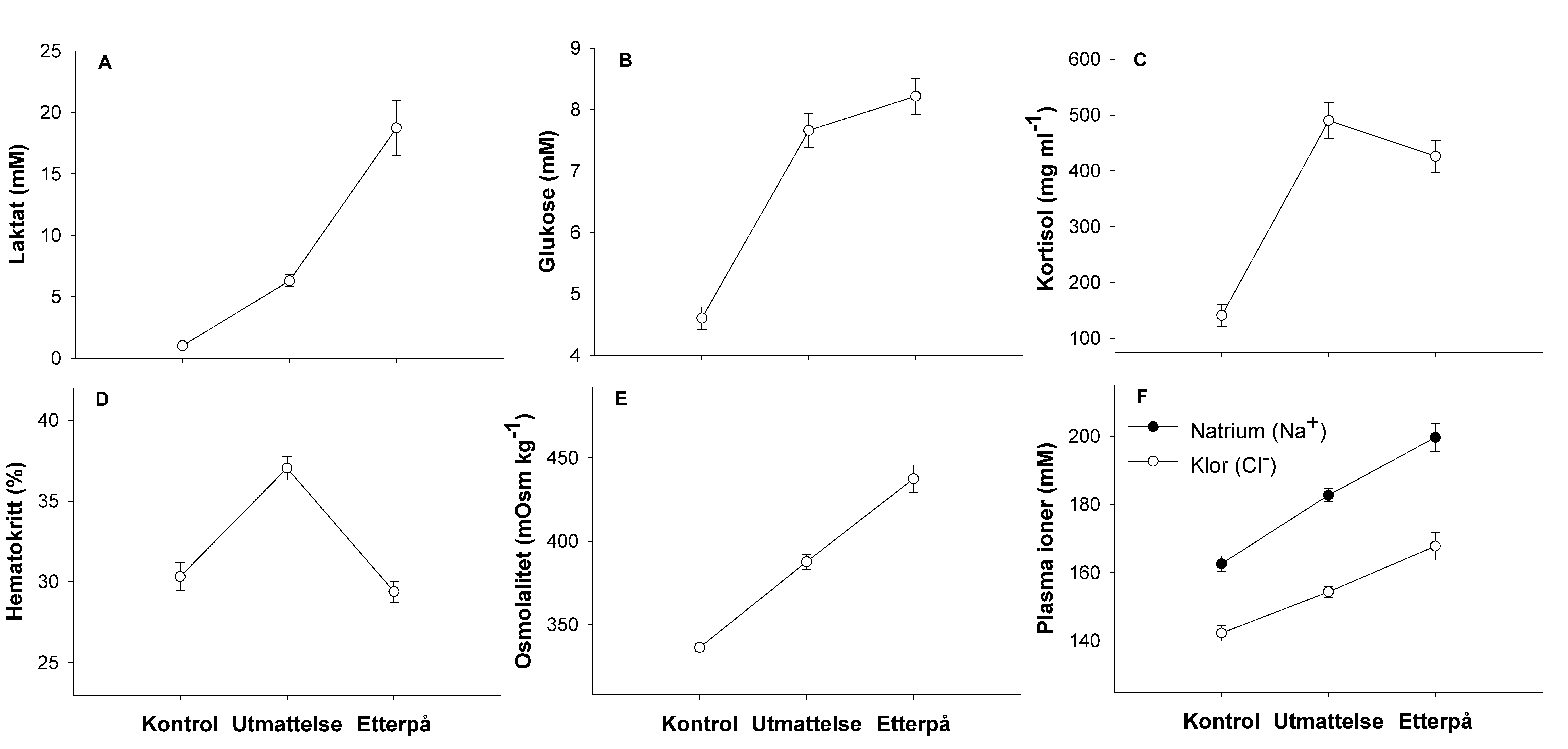
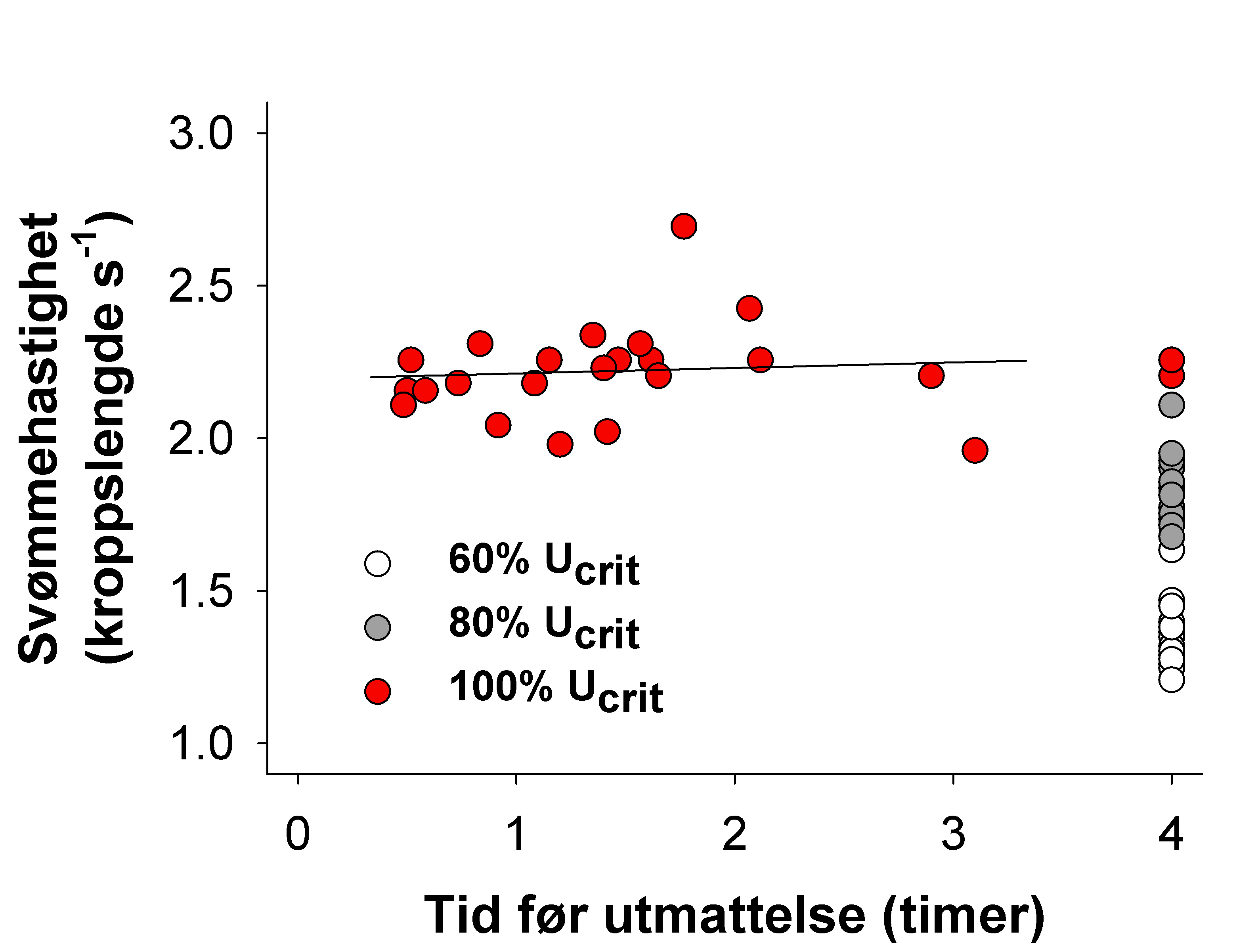
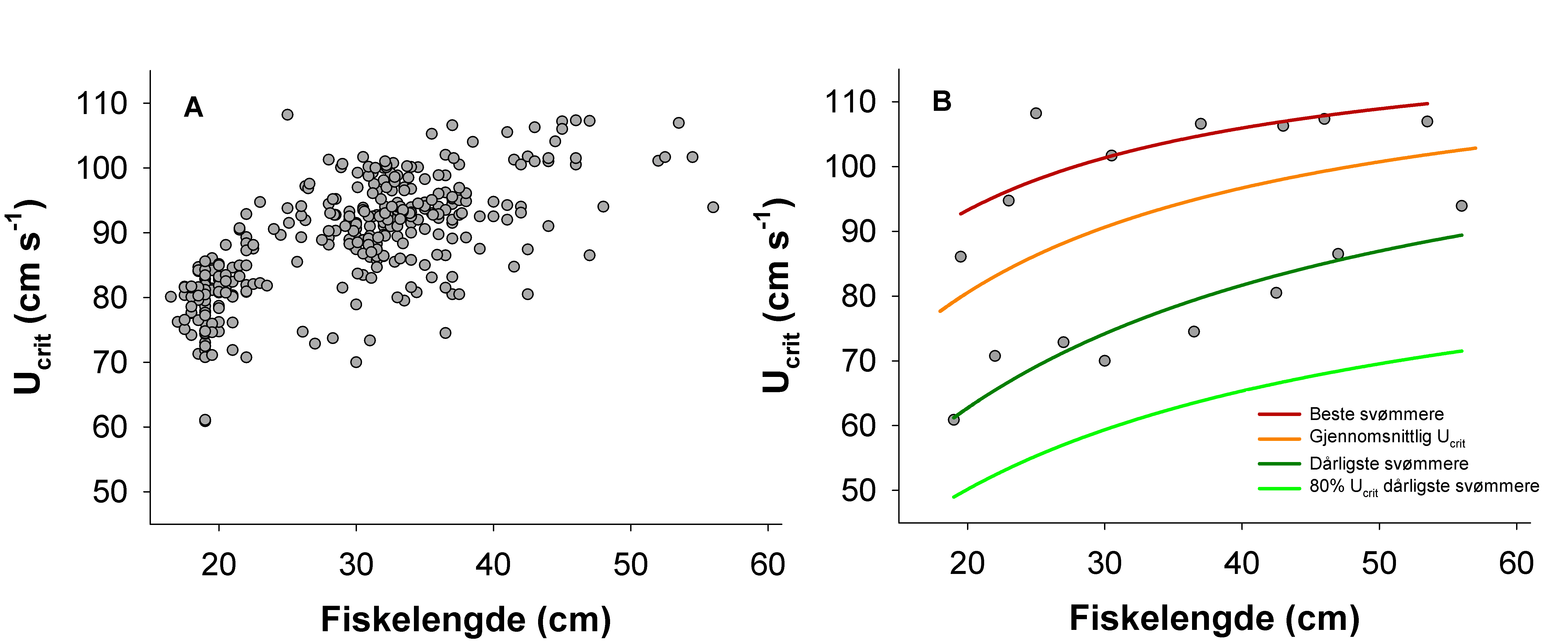
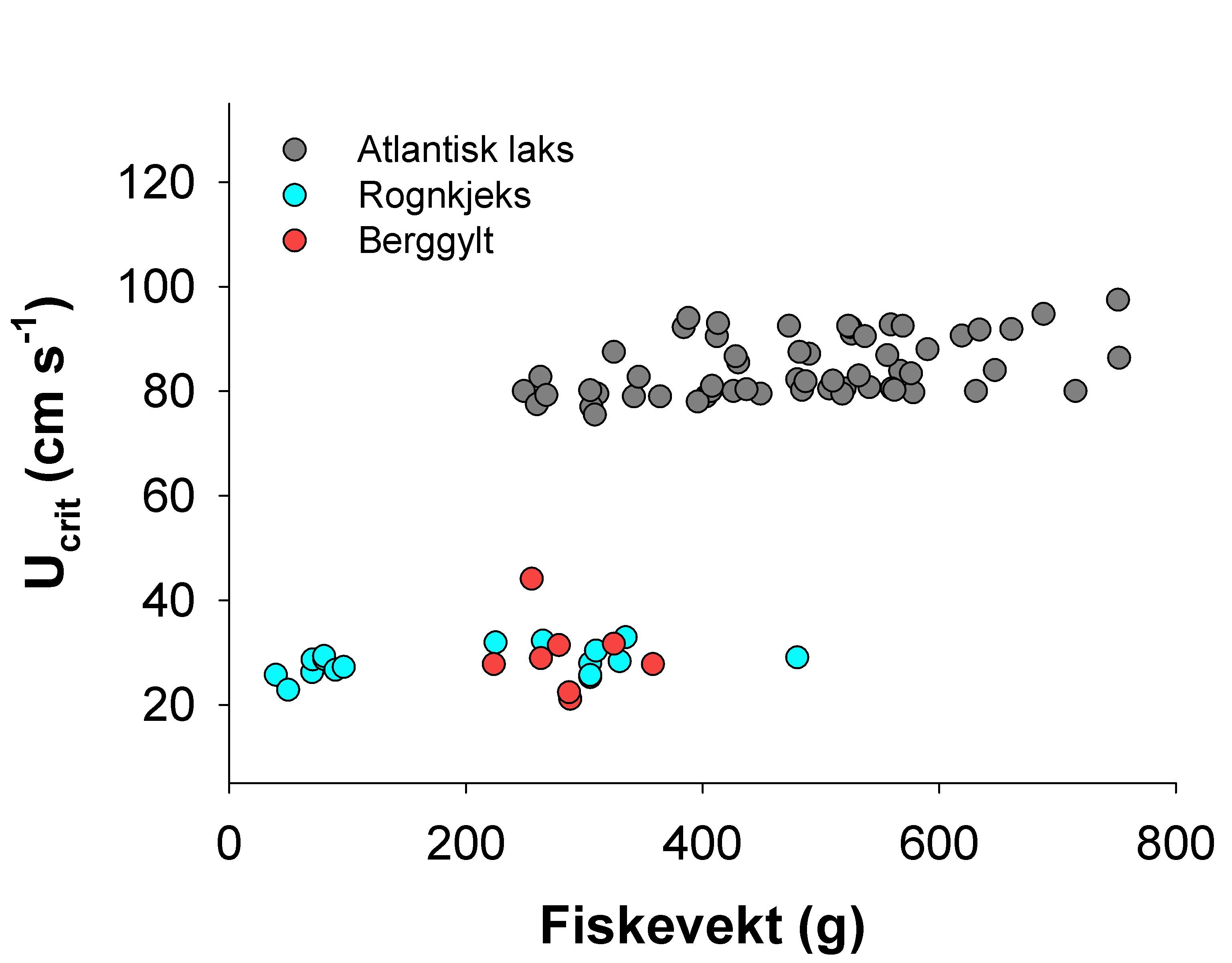
Hvas, M. & Oppedal, F. (2017). Sustained swimming capacity of Atlantic salmon. Aquaculture Environment Interaction 9, 361-369.
Hvas, M., Karlsbakk, E., Mæhle, S., Wright, D. & Oppedal, F. (2017a). The gill parasite Paramoeba perurans compromises aerobic scope, swimming capacity and ion balance in Atlantic salmon. Conservation physiology 5, cox066.
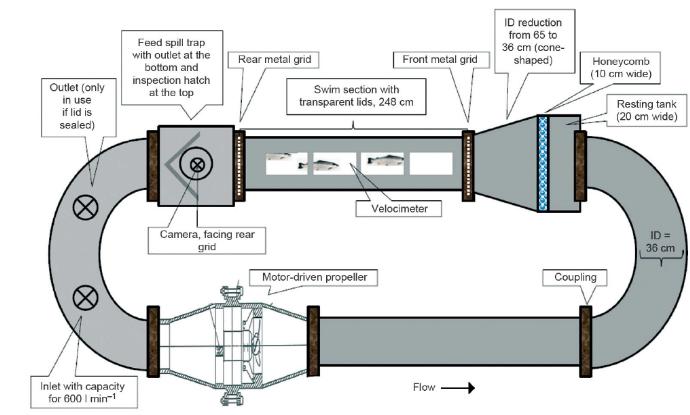
Hvas, M., Folkedal, O., Solstorm, D., Vågseth, T., Fosse, J. O., Gansel, L. C. & Oppedal, F. (2017b). Assessing swimming capacity and schooling behaviour in farmed Atlantic salmon Salmo salar with experimental push-cages. Aquaculture 473, 423–429.
Hvas, M., Folkedal, O., Imsland, A & Oppedal, F. (2017c). The effect of thermal acclimation on aerobic scope and critical swimming speed in Atlantic salmon, Salmo salar. Journal of Experimental Biology 220, 2757-2764.
Hvas, M., Nilsen, T. O. & Oppedal, F. (2018a). Oxygen uptake and osmotic balance of Atlantic salmon in relation to exercise and salinity acclimation. Frontiers in Marine Science 5, 368.
Hvas, M., Folkedal, O., Imsland, A. & Oppedal, F. (2018b). Metabolic rates, swimming capabilities, thermal niche and stress response of the lumpfish, Cyclopterus lumpus. Biology Open 7, bio036079.
Imsland, A. K., Reynolds, P., Eliassen, G., Hangstad, T. A., Foss, A., Vikingstad, A. & Elvegård, T. A. (2014). The use of lumpfish (Cyclopterus lumpus L.) to control sea lice (Lepeophtheirus salmonis Krøyer) infestations in intensively farmed Atlantic salmon (Salmo salar L.). Aquaculture 424, 18-23.
Imsland, A., Hanssen, A., Nytrø, A., Reynolds, P., Jonassen, T., Hangstad, T., Elvegård, T., Urskog, T. & Mikalsen, B. (2018). It works! Lumpfish can significantly lower sea lice infestation in large-scale salmon farming. Biology Open 7(9), p.bio036301
Intrafish (2017). Anlegget tålte orkanerne, men fisken måtte slaktes. https://www.intravish.no/nyheter/1206781/anlegget-taalte-orkanene-men-fisken-maatte-slakte
Iversen, M., Finstad, B., McKinley, R. S., Eliassen, R. A., Carlsen, K. T., Evjen, T. (2005). Stress responses in Atlantic salmon (Salmo salar L.) smolts during commercial well boat transports, and effect on survival after transfer to sea. Aquaculture 243, 373-382.
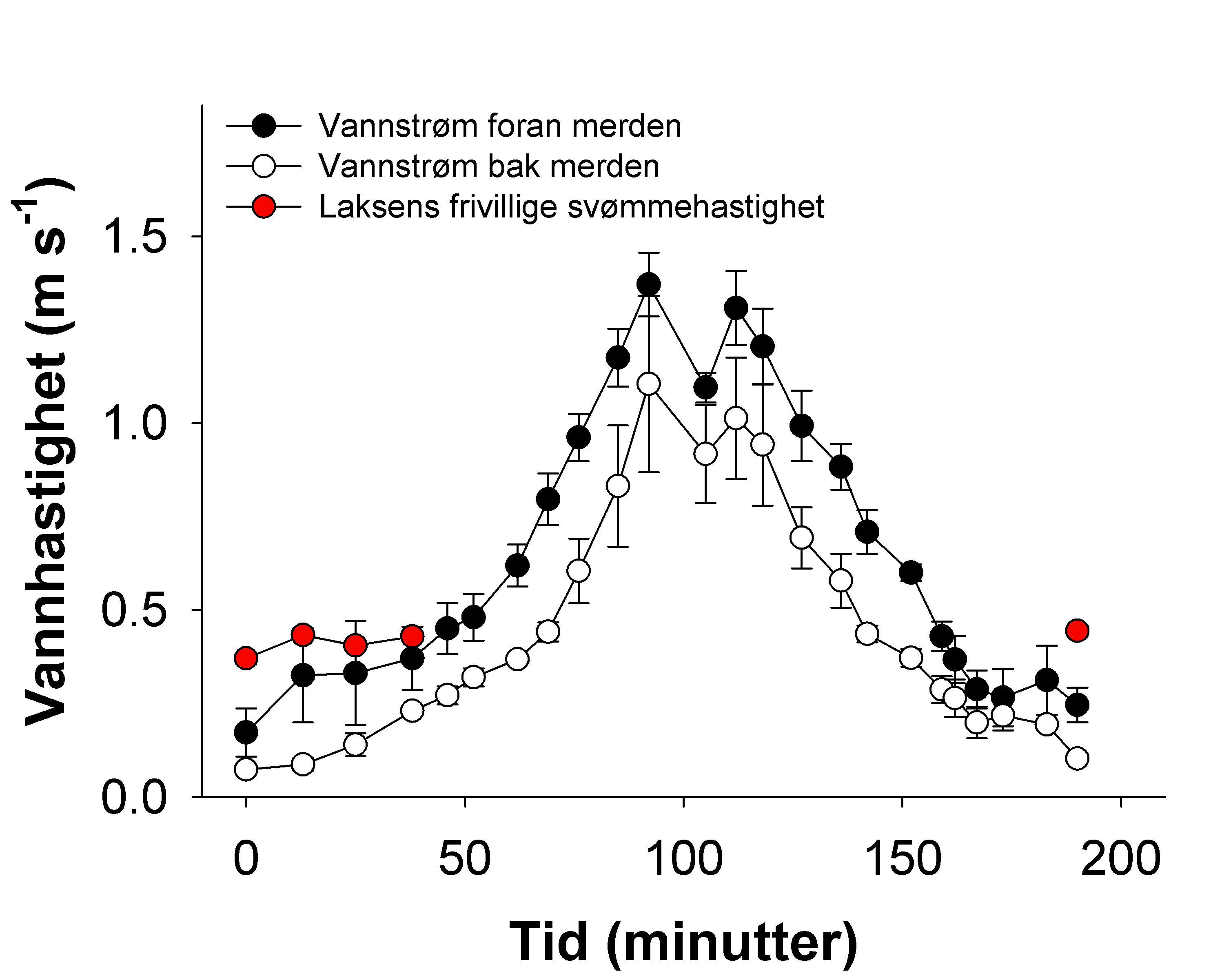
Johansson, D., Laursen, F., Fernö, A., Fosseidengen, J.E., Klebert, P., Stien, L.H., Vågseth, T. & Oppedal, F. (2014). The interaction between water currents and salmon swimming behaviour in sea cages. PLoS One 9, e97635.
Jónsdóttir, H., Bron, J.E., Wootten, R., Turnbull, J.F. (1992). The histopathology associated with the pre-adult and adult stages of Lepeophtheirus salmonis on the Atlantic salmon, Salmo salar L. J Fish Dis 15: 521−527
Jones, D. R. (1982). Anaerobic exercise in teleost fish. Canadian Journal of Zoology 60, 1131− 1134
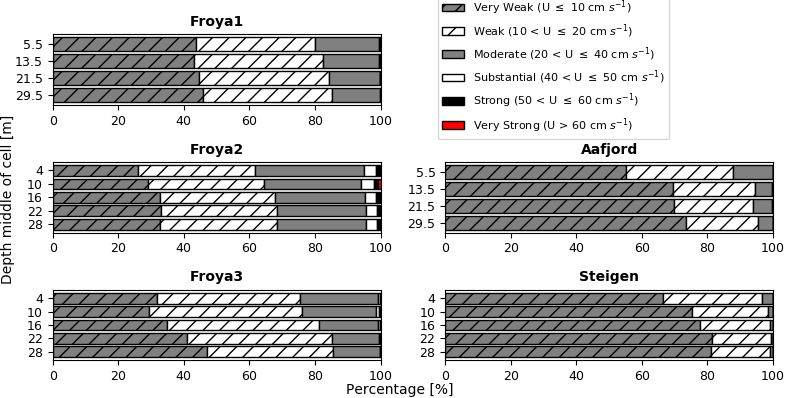
Jónsdóttir, K. E., Hvas, M., Alfredsen, J. A., Føre, M., Alver, M. O., Bjelland, H. V. & Oppedal, F. (2019). Fish welfare based classification method of ocean current speeds at aquaculture sites. Aquaculture Environment Interaction 11, 249-261.
Kieffer, J. D. (2000). Limits to exhaustive exercise in fish. Comp. Biochem.Physiol. A 126, 161–179.
Killen, S. S., Brown, J. A. & Gamperl, A. K. (2007). The effect of prey density on foraging mode selection in juvenile lumpfish: balancing food intake with the metabolic cost of foraging. J. Anim. Ecol. 76, 814-825
Kim, W-S., Kong, K-H., Kim, J-O., Jung, S-J., Kim, J-H. & Oh, M-J. (2017). Amoebic gill disease outbreak in marine fish cultured in Korea. J. Vet. Diagn. Invest. 29, 357–361
Klebert, P., Patursson, Ø., Endresen, P. C., Rundtop, P., Birkevold, J. & Rasmussen, H. W. (2015). Three-dimensional deformation of a large circular flexible sea cage in high currents: Field experiment and modeling. Ocean Engineering 104, 511-520.
Klebert, P., Gansel, L., Lader, P., Oppedal, F. (2013). Flow hydrodynamics through nets and floating cages: a review. Ocean Engineering 58, 260-274.
Kullgren, A., Jutfelt, F., Fontanillas, R., Sundell, K., Samuelsson, L.,Wiklander, K., Kling, P., Koppe, W., Larson, D. G. J., Bj rnsson, B. T. et al. (2013). The impact of temperature on the metabolome and endocrine metabolic signals in Atlantic salmon (Salmo salar). Comp. Biochem. Physiol. A 164, 44-53.
Kyst.no. (2018). Glimt av håp for rensefisken. www.kyst.no/article/glimt-av-haap-for-rensefisken/
Lader, P., Dempster, T., Fredheim, A. & Jensen, Ø. (2008). Current induced net deformations in full-scale sea-cages for Atlantic salmon (Salmo salar). Aquaculture Engineering 38, 52- 65.
Leclercq, E., Davie, A. & Migaud, H. (2014). Delousing efficiency of farmed ballan wrasse (Labrus bergylta) against Lepeophtheirus salmonis infecting Atlantic salmon (Salmo salar) post-smolts. Pest Management Science 70(8), 1274-1282.
Liu, Y., Bjelland, H. (2014). Estimating costs of sea lice control strategy in Norway. Preventive Veterinary Medicine 117, 469-477.
Loverich, G.F. & Gace, L. (1997). The effects of currents and waves on several classes of offshore sea cages. In: Helsley, C.E. (Ed.), Open Ocean Aquaculture: Charting the Future of Ocean Farming. University of Hawaii, Maui, Hawaii, USA, pp. 131–144.
Millot, S., Nilsson, J., Fosseidengen, J. E., Bégout, M. –L., Fernö, A., Braithwaite, V. A. & Kristiansen, T. S. (2014). Innovative behaviour in fish: Atlantic cod can learn to use an external tag to manipulate a self-feeder. Animal Cognition 17, 779-785.
Naylor, R. L., Hardy, R. W., Bureau, D. P., Chiu, A., Elliott, M., Farrell, A. P., Forster, I., Gatlin, D. M., Goldburg, R. J., Hua, K. & Nichols, P. D. (2009). Feeding aquaculture in an era of finite resources. Proceedings of the National Academy of Sciences 106 (36), 15103-15110.
Nilsson, J., Kristiansen, T. S., Fosseidengen, J. E., Stien, L. H., Fernö, A. & van den Bos, R. (2010). Learning and anticipatory behaviour in a ―sit-and-wait‖ predator: The Atlantic halibut. Behavioural Processes 83, 257–266.
Noble, C., Gismervik, K., Iversen, M. H., Kolarevic, J., Nilsson, J., Stien, L. H., Turnbull, J. F. (2018). Welfare Indicators for farmed Atlantic salmon: tools for assessing fish welfare 351pp.
Norwegian Directorate of Fisheries. (2018). Cleanerfish (Lumpfish and Wrasse). [online] Available at: https://www.fiskeridir.no/English/Aquaculture/Statistics/Cleanerfish-Lumpfish-and-Wrasse
Oldham, T., Rodger, H. & Nowak, B. F. (2016). Incidence and distribution of amoebic gill disease (AGD) - an epidemiological review. Aquaculture 475, 35–42.
Oldham, T., Oppedal, F., Dempster, T. (2018). Cage size affects dissolved oxygen distribution in salmon aquaculture. Aquaculture Environment Interactions 10, 149-156.
Oldham, T., Nowak, B., Hvas, M. & Oppedal, F. (2019). Metabolic and functional impacts of hypoxia vary with size in Atlantic salmon. Comparative Biochemistry and Physiology A 231, 30-38.
Oppedal, F., Dempster, T. & Stien, L., (2011). Environmental drivers of Atlantic salmon behaviour in sea-cages: a review. Aquaculture 311, 1–18.
Overton, K., Dempster, T., Oppedal, F., Kristiansen, T., Gismervik, K. & Stien, L. (2018). Delousing operations and salmon mortality in Norwegian aquaculture: a review. Reviews in Aquaculture, pp.1-20.
Paulitz, T. & Bélanger, R. (2001). Biological control in greenhouse systems. Annual Review of Phytopathology 39, 103-133.
Plaut, I. (2001). Critical swimming speed: its ecological relevance. Comp Biochem Physiol A Mol Integr Physiol 131,41–50.
Powell, A., Treasurer, J. W., Pooley, C. L., Keay, A. J., Lloyd, R., Imsland, A. K &, Garcia de Leaniz, C. (2017). Use of lumpfish for sea-lice control in salmon farming: challenges and opportunities. Reviews in Aquaculture 10, 683-702.
Remen, M., Solstorm, F., Bui, S., Klebert, P., Vågseth, T., Solstorm, D., Hvas, M. & Oppedal, F. (2016). Critical swimming speed in groups of Atlantic salmon Salmo salar. Aquaculture Environment Interaction 8, 659-664.
Sharma, R., Singh, D. & Singh, R. (2009). Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: A review. Biological Control 50(3), 205-221.
Solstorm, F., Solstorm, D., Oppedal, F., Fernö, A., Fraser, T. W. K. & Olsen, R. E. (2015). Fast water currents reduce production performance of post-smolt Atlantic salmon Salmo salar. Aquaculture Environment Interaction 7, 125−134.
Stien, L. H., Lind, M. B., Oppedal, F., Wright, D. W. & Seternes, T. (2018). Skirts on salmon production cages reduced salmon lice infestations without avfecting fish welfare. Aquaculture 490, 281-287.
Taksdal, T., Olsen, A. B., Bjerkås, I., Hjortaas, M. J., Dannevig, B. H., Graham, D. A. & McLoughlin, M. D. (2007). Pancreas disease in farmed Atlantic salmon, Salmo salar L., and rainbow trout, Oncorhynchus mykiss (Walbaum), in Norway. Journal of Fish Diseases 30, 545-558.
Vaughan, D., Grutter, A., Hutson, K. (2018). Cleaner shrimp are a sustainable option to treat parasitic disease in farmed fish. Scientific Reports 8, 1-20.
Verdegen, M. C. J. (2013). Nutrient discharge from aquaculture operations in function of system design and production environment. Reviews in Aquaculture 5, 158-171.
Wagner, G.N., McKinley, R.S., Bjørn, P.A., Finstad, B. (2003). Physiological impact of sea lice on swimming performance of Atlantic salmon. J Fish Biol 62: 1000−1009
Wagner, G.N., Fast, M.D., Johnson, S.C. (2008). Physiology and immunology of Lepeophtheirus salmonis infections of salmonids. Trends Parasitol 24: 176−183
Walker, J. & Westneat, M. (1997). Labriform propulsion in fishes: kinematics of flapping aquatic flight in the bird wrasse Gomphosus varius (Labridae). Journal of Experimental Biology 200, 1549–1569.
Walker, J. & Westneat, M. (2002). Performance limits of labriform propulsion and correlates with fin shape and motion. Journal of Experimental Biology 205, 177–187.
Wang, X., Olsen, L. M., Reitan, K. I., & Olsen, Y. (2012). Discharge of nutrient wastes from salmon farms: environmental effects, and potential for integrated multi-trophic aquaculture. Aquaculture Environment Interactions 2, 267-283.
Webb, P. (1984). Form and function in fish swimming. Scientific American, 251(1), pp.72-82.
Weihs, D. (1973). Optimal cruising speed for migrating fish. Nature 245, 48–50.
Wilson, R. W. & Egginton, S. (1994). Assessment of maximum sustainable swimming performance in rainbow trout (Oncorhynchus mykiss). Journal of Experimental Biology 192, 299−305
Wood, C. M., Turner, J. D. & Graham, M. S. (1983). Why do fish die avter severe exercise? J. Fish. Biol. 22, 189-201.
Wood, C. M. (1991). Acid-base and ion balance, metabolism, and their interactions, avter exhaustive exercise in fish. Journal of Experimental Biology 160, 285−308.
Wright, D. W., Geitung, L., Karlsbakk, E., Stien, L. H., Dempster, T., Oldham, T., Nola, V. & Oppedal, F. (2018). Surface environment modification in Atlantic salmon sea cages: effects on amoebic gill disease, salmon lice, growth and welfare. Aquaculture Environment Interactions 10, 255-265.